近日,国家纳米科学中心孙佳姝课题组与中国人民解放军总医院第五医学中心江泽飞教授、张少华教授,复旦大学附属肿瘤医院戴波教授等合作,在基于功能核酸的微流控热泳生物传感领域取得系列进展。相关研究成果近期分别发表于《自然·通讯》(Nature Communications, 2021, 12, 2536)及《纳米·今日》(Nano Today, 2021, 38, 101203)。
转移性乳腺癌(MBC)是一种包括多种不同亚型的异质性疾病,是全球女性癌症死亡的主要原因之一。外周血中肿瘤来源的细胞外囊泡(EVs)作为液体活检的重要靶标,在MBC的精准诊断和疗效评估方面具有重要的应用前景。研究人员采用一种快速、灵敏、低成本微流控热泳适体传感器,对血浆EV的乳腺癌相关蛋白质特征进行分析,有效排除血浆游离蛋白干扰(Nature Communications, 2021, 12, 2536)。设计了一种机器学习算法,基于8种EV乳腺癌蛋白表达水平构建EV蛋白特征,用于区分MBC患者、非转移性乳腺癌患者、年龄配对的健康对照者,准确率高达91.1 %。在训练队列、验证队列、前瞻队列研究中,EV蛋白特征可以监测MBC的治疗反应,对治疗后疾病进展(PD)与稳定/部分缓解(SD/PR)的区分准确率为88.5 %。EV蛋白特征还与接受治疗的MBC患者的无进展生存期(PFS)相关,其中前列腺癌生物标志物EV PSMA可以作为MBC患者PFS的独立预后因素。论文的第一作者为国家纳米科学中心特别研究助理田飞博士与中国人民解放军总医院第五医学中心张少华教授;通讯作者为国家纳米科学中心孙佳姝研究员、刘超研究员与中国人民解放军总医院第五医学中心江泽飞教授。
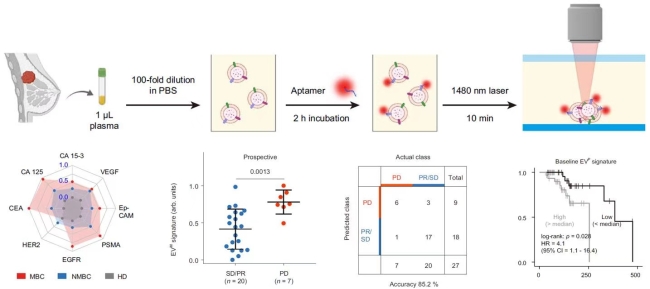
图1:基于热泳适体传感器的EV表面蛋白检测与乳腺癌精准诊断应用
EV携带肿瘤细胞的mRNA,在转录水平调控肿瘤增殖与转移,是一种重要的癌症诊断标志物。为克服qRT-PCR检测操作复杂、需要裂解大量EV等挑战,研究人员发展了结合DNA四面体探针与热泳汇聚的检测新方法(DTTA),实现了血清中EV mRNA的原位、高灵敏检测,检出限低至14 aM(Nano Today, 2021, 38, 101203)。DNA四面体探针具有较高的结构刚性,可通过被动输运高效进入外泌体,并依靠双悬臂特异识别EV中靶标PSA mRNA,产生荧光共振能量转移(FRET)信号。进一步通过热泳富集放大EV中的FRET信号,实现EV PSA mRNA的原位高灵敏检测,无需EV裂解、RNA提取、反转录等过程。使用DTTA测量前列腺穿刺病人的血清EV PSA mRNA含量,可以有效区分前列腺癌患者(PCa)与前列腺良性增生患者(BPH),AUC为0.93,显著优于血清生物标志物PSA(AUC 0.74),为前列腺癌精准检测提供了新思路。本论文的第一作者为国家纳米科学中心博士研究生韩子威、邓瑾琦与复旦大学附属肿瘤医院万方宁博士;通讯作者为国家纳米科学中心孙佳姝研究员、刘超研究员与复旦大学附属肿瘤医院戴波教授。
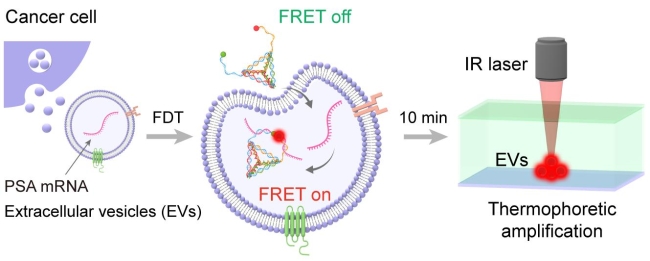
图2:基于DNA四面体探针与热泳汇聚的肿瘤外泌体mRNA高灵敏、原位检测
上述系列研究工作获得国家自然科学基金委杰出青年科学基金和重大研究计划,中国科学院战略性先导科技专项(B类),中国科学院基础前沿科学研究计划和科研仪器设备研制项目等资助。
 版权所有@中国科学院纳米标准与检测重点实验室
版权所有@中国科学院纳米标准与检测重点实验室 联系方式:北京市海淀区中关村北一条11号(100190) 电话:010-82545691 传真:010-62656765
E-mail: baoxf@nanoctr.cn
 当前位置:
当前位置: