淀粉样蛋白(多肽)纤维化与淀粉样蛋白(多肽)的错误折叠有关,这其中包括阿尔茨海默氏症、帕金森症、 II 型糖尿病、疯牛病等蛋白质构象异构病的关键致病蛋白。利用X射线衍射(XRD) ,固态核磁(NMR)和扫描探针显微镜(AFM),发现阿尔茨海默氏症(AD)中,淀粉样多肽Aβ通过分子间氢键作用和侧基间疏水相互作用,形成平行 的β片层发卡结构,这是Aβ聚集形成纤维的分子结构基础。Aβ从β片层发卡结构的单体聚集成成熟纤维直到形成老年斑整个聚集过程中,存在很多种中间体,例如可溶性的寡聚体、原纤维、纤维等,都具有不同程度的细胞毒性。
杨延莲课题组通过多种方法对 Aβ 聚集的不同阶段进行调控,试图寻找有效的抑制剂抑制 Aβ的神经毒性。其中一大类就是多肽抑制剂,多肽抑制剂的核心部分是具有一定氨基酸序列的短肽片段。对于 Aβ的聚集,起到关键作用的是多肽中某些特定区域,它们之间较强的相互作用,使多肽聚集为具有特定形貌和尺寸的聚集体。若确定了这些特定的区域,再合成相同序列的短肽片段,使之与 Aβ相应部位进行特异性识别,就会有效的扰乱 Aβ-Aβ 之间的相互作用,从而达到抑制 Aβ聚集的效果。在这项工作中,选取与Aβ全长的相互作用能力最强的Aβ16-20 (KLVFF)作为多肽抑制剂片段,和有机小分子三吡啶分子用于构建抑制效果更加明显的新型多肽-有机小分子共组装抑制剂。吡啶分子通过氢键相互作用能够与KLVFF多肽分子的C末端相互作用形成共组装体。利用扫描隧道显微镜(STM),发现多肽和三吡啶分子摩尔比的变化,显著影响多肽-三吡啶共组装结构。理论计算和分子模拟结果很好的佐证了STM得到的共组装结构的可靠性。傅里叶变换红外(FT-IR)光谱和原子力显微镜进一步揭示不同的多肽-三吡啶共组装结构中KLVFF二级结构存在变化,从而影响了聚集结构的变化。所以分子相互作用形式及其构成的共组装结构,对于多肽的二级结构和聚集过程会产生极大的影响。最终,研究多肽-三吡啶分子共组装体对Aβ42聚集和细胞毒性的抑制效果,组装结构多样性与抑制效果之间的关系。本工作研究多肽分子-有机分子共组装的多样性,共组装体各部分的协同抑制效应,这种新型抑制剂和淀粉样多肽聚集调节方法为神经退行性疾病的诊断和治疗提供了新思路。
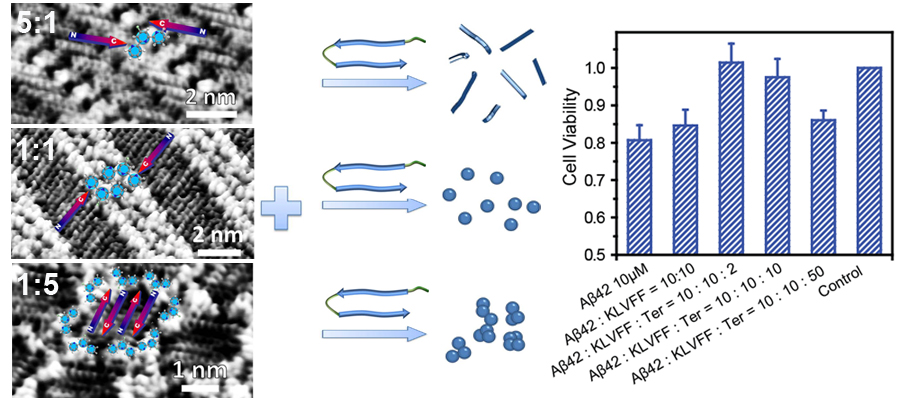
图1吡啶类小分子-短肽复合物对Ab多肽聚集和毒性的协同抑制效应
相关工作发表在 ACS Nano 2016, 10, 4143上